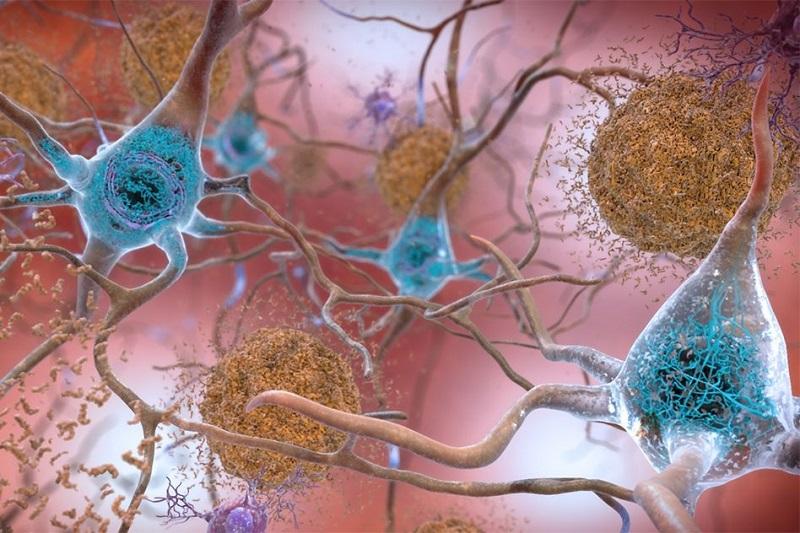
مغز افراد مبتلا به آلزایمر، پارکینسون و دیگر بیماریهای نورودژنراتیو، مملو از پروتئینهای مشخص در داخل یا اطراف نورونهای آنها است. اینکه چگونه این تودههای پروتئین میتوانند به نورونها آسیب بزنند هنوز مشخص نیست، اما وجود تودههای پروتئینی نشانه این بیماریها هستند که بیشتر در مغز افراد مسن و سالخورده مشاهده شده است (شکل 1).

شکل1 - نورون مغز بیمار مبتلا به آلزایمر است که تجمع غیرعادی پروتئین تاو (tau) بهصورت انبوهی از الیاف قرمز در نزدیکی هسته سلول را نشان میدهد. این انباشتگیها نشانههایی از بیماری هستند، اما بهنظر میرسد تجمع پروتئین با افزایش سن در کل بدن اتفاق میافتد.
پژوهشی که بهتازگی توسط تیمی از محققان دانشگاه استنفورد انجام گرفته، نشان میدهد تجمع پروتئین ممکن است یک پدیده کلی و مشترک در سلولهای پیر باشد و بیش از آنچه تصور میشد، میتواند در برخی از بیماریهای مرتبط با سالخوردگی تاثیرگذار باشد. دستاورد این تیم تحقیقاتی نشان میدهد با افزایش سن تغییرات مهمی در سلولها اتفاق میافتد که میتوان با استفاده از روشهای نوین با آن مقابله کرد یا دستکم پیامدهای منفی آنرا به حداقل رساند.
دلا دیوید (Della David) که تحقیقات مرتبط با حوزه پیری و سالخوردگی را انجام میدهد، در این ارتباط میگوید: «تجمع پروتئین فقط مختص یک بافت نیست، بلکه بافتهای مختلف زیادی را تحت تاثیر قرار میدهد».
این تحقیق نشان میدهد که تجمع پروتئین با مکانیسمهای اساسی ارتباط تنگاتنگی دارد که به سلولها اجازه میدهد فیزیولوژی خود را با ظرافت خاصی تنظیم کنند. زیستشناسان باید بهدقت و بهشکل موردی به ارزیابی این مسئله بپردازند که آیا تجمع پروتئین برای سلولها تهدید محسوب میشود یا نوعی حالت تدافعی است (شکل 2).

شکل 2 - در این بخش از بافت مغزی فرد مبتلا به بیماری فلج فوق هستهای پیشرونده، تجمعات پروتئین تاو (قهوهای) فضاهای بین نورونها را مسدود میکند.
مقاله جدیدی که ماه مارس در سایت biorxiv.org منتشر شد، بیانگر اولین تلاشها برای تعیین کمیت تجمع پروتئین در سراسر بدن در روال طبیعی پیری یک جانور مهرهدار (یک ماهی با عمر بسیار کوتاه) است. این مطالعه نشان داد که تجمع پروتئین احتمالا موجب زوال تدریجی بسیاری از بافتها در طول زمان میشود. این یافتهها حتا به این موضوع اشاره دارند که چرا این تودهها در مغز بسیار واضحتر از سایر بافتها هستند؛ یکی از دلایل احتمالی آن ممکن است سرعت بالای تکامل مغز باشد. دن جاروس (Dan Jarosz)، زیستشناس سیستمها در استنفورد که با همکار خود آن برونت (Anne Brunet)، متخصص ژنتیک، بر این آزمایشها نظارت میکردند، انتظار این تعداد پروتئینهای تجمیعشده در ماهیهای پیر را نداشتند و نمیدانستند چه مقدار از همین پروتئینها، در اشکال جهشیافته با بیماریهای دژنراتیو مرتبط هستند. او میگوید: «این موضوع من را به این فکر انداخت که آیا امکان دارد بیشتر بیماریهای مرتبط با سن که ما در حال حاضر ارتباطی بین آنها و تجمع پروتئینها کشف نکردهایم، در واقع با یکدیگر مرتبط باشند».
سرنخهای بهدستآمده از یک ماهی
کلیفیشها، ماهیهای فیروزهای آفریقایی، که زیستگاهشان حوضچههایی در شرق آفریقا است و در فصل بارندگی پرورش داده میشوند، عمر بسیار کوتاهی دارند. هنگامی که این ماهیها به پایان عمر کوتاه 4 تا 6 ماهه خود نزدیک میشوند، به طیف وسیعی از بیماریهای مرتبط با افزایش سن، از جمله آب مروارید و تغییرات مرتبط با مغز که شبیه اختلالات عصبی مانند آلزایمر در انسان است، مبتلا میشوند. این ماهیها که عمر کوتاهی حتا کمتر از یک موش آزمایشگاهی دارند، روند طبیعی پیری را بهسرعت طی میکنند و همین امر موجب شده تا به مدلی ایدهآل برای مطالعه محققان در زمینه پیری در مهرهداران، تبدیل شوند.
داریو والنزانو (Dario Valenzano)، زیستشناس تکاملی میگوید: «نکته قابل تاملی که در ارتباط با ماهی فوق وجود دارد این است که فقط تجمع پروتئین یا نارسایی قلبی یا اختلال عملکرد مغزی با افزایش سن در این بیماری اتفاق نمیافتد و تقریبا هر اندام و بافتی که به آن نگاه میکنیم با روند افزایش سن با تغییرات مخربی روبهرو میشود ». (شکل 3)

شکل3 - کیلیفیش فیروزهای آفریقایی، جانوری با طول عمر بسیار کوتاه 4 تا 6 ماه است. این ماهی همانطور که از جوانی (تصویر بالا) به پیری (تصویر پایین) میرسد، با مشکلات زیادی روبهرو میشود که شباهت زیادی به روند پیری در انسانها دارد.
تیم آقای استنفورد، تجزیهوتحلیل گستردهای در خصوص پروتئینهای کیلیفیش در مراحل مختلف جوانی و بلوغ انجام دادند. در ماهیهای پیر و سالخورده، محققان به هر بافتی نگاه میکردند شاهد تجمع پروتئین بودند؛ نهتنها مغز، بلکه قلب، روده، کبد، ماهیچه، پوست و غیره. در آزمایشهای بعدی بهنظر میرسید که بیش از نیمی از پروتئینهای انباشتهشده، تمایل ذاتی به تجمع و انباشتگی نشان میدهند.
اینکه دقیقا کدام پروتئینها انباشته میشوند، در واقع از بافتی به بافت دیگر متفاوت است. بسیاری از پروتئینها در سطوحی اساسا یکسان در چند بافت ظاهر میشوند. در حالی که این پروتئینها در یک بافت جمع میشوند، اما در سایر بافتها این انباشتگی مشاهده نمیشود.
دیوید میگوید: «گستردگی بافتی پروتئوم انباشتهشده، بسیار شگفتانگیز است». او و برخی دیگر از محققان بر این باور هستند که این تفاوتها نشان میدهند که چگونه سلولها کیفیت پروتئینهای خود را حفظ میکنند. سلولها سازوکار پیچیدهای دارند تا اطمینان حاصل کنند که مولکولهای طولانی و زنجیرهای پپتید که پروتئینها را تشکیل میدهند، منعطف هستند و در نهایت پپتیدها برای بازیابی قابلیت از هم گسسته شدن را دارند، اما بافتها بهلحاظ میزان وابستگی به جنبههای مختلف فرآیند کنترل کیفیت پروتئین با هم متفاوت هستند و این امر احتمالا با افزایش سن تغییر میکند.
سینتیا کنیون (Cynthia Kenyon)، معاون تحقیقات حوزه پیری شرکت بیوتکنولوژی Calico Life Sciences میگوید: «این مسئله واقعا مهم است، زیرا یک معمای بزرگ در زیستشناسی انسان است. به چه دلیل این بیماریهای عصبی تا حد زیادی مختص بافتها هستند.» بهعنوان مثال، هیچکس واقعا نمیداند که چرا پلاکهای پروتئین آمیلوئید بیماری آلزایمر در هیپوکامپ مغز تشکیل میشوند. بهطوریکه این انباشتگی در بیماری پارکینسون مختص نورونهای دوپامین است. او میگوید: «احتمالا سلولهای مختلف کیفیت پروتئین خود را بهشکل متفاوتی حفظ میکنند و این میتواند حداقل دلیلی باشد که چرا بافتهای مختلف باید متفاوت رفتار کنند».
اهمیت کنترل کیفیت
شواهد بهدستآمده از مطالعه روی کرمها و مگسها نشان میدهد اگر سازوکاری که پایداری پروتئینها را حفظ میکند مختل شود، حیوانات سریعتر پیر میشوند. اگر مسیرهای کنترل کیفیت پروتئین از نظر ژنتیکی افزایش یابند، این حیوانات مدت زمان بیشتری زندگی میکنند. هیچکدام از این حرفها به این معنی نیست که تجمع پروتئین باعث پیری میشود، اما بهشکل عجیبی نشان میدهد ارتباط تنگاتنگی میان این دو وجود دارد.
برای بررسی بیشتر رابطه بین تجمع پروتئین و پیری، محققان استنفورد با دقت بیشتری پروتئینهای موجود در انواع جهشیافته کیلیفیشها که بهطور غیرعادی و سریع روند پیری را طی میکنند، تحت نظر گرفتند. این ماهیها دارای یک جهش در ژن آنزیم تلومراز خود هستند که طول کروموزومهای تقسیمشده را حفظ میکند؛ حیواناتی که جهش تلومراز دارند معمولا بهسرعت پیر میشوند.
جاروس در بخشی از صحبتهای خود به این نکته اشاره دارد که او و همکارانش انتظار داشتند در روده و دیگر بافتهایی که رشد سریعی دارند یا جایگزین میشوند، شاهد تجمع کمتری باشند، زیرا تقسیم سلولی اضافی به بافتهایی که بهسرعت در حال رشد هستند فرصت بیشتری برای پاک کردن تودهها و بازسازی خود میدهد، اما این موضوع برعکس بود. بافتهایی که بهسرعت رشد میکردند، پروتئینهای انباشته و کژتابیده بیشتری داشتند و نسبت به بافتهایی که آهسته رشد میکردند، سریعتر پیر میشدند.
بار دیگر، مشکلات مربوط به کنترل سلول بر کیفیت پروتئینهایش میتواند بهعنوان توجیه این مسئله مطرح شود. اگر سلولها کنترل خود بر فرآیندهایی که کیفیت پروتئینها را حفظ میکنند از دست بدهند، ممکن است با هر تقسیم سلولی آسیب بیشتری ببینند. بافتهایی که بهسرعت رشد میکنند ممکن است سریعتر پیر شوند، زیرا شانس بیشتری برای انباشتگی این آسیب را دارند.
چگالش، تجمع و پریونها
چرا گاهیاوقات تجمع پروتئینها پیچیده است؟ با کمال تعجب، بخشی از پاسخ این سوال به مکانیزم مهمی که چگالش نام دارد، مرتبط است که سلولها برای کنترل پروتئینهای خود از آن استفاده میکنند.
اشکال پیچیده سه بعدی که پپتیدها به آن تبدیل میشوند، از دیرباز بهعنوان دیکتهکننده فعالیتها و عملکرد پروتئینهایی در نظر گرفته میشوند که آنها را ساختهاند. اما حدود یک دهه قبل، کشف شد که فهرست روبهرشدی از پروتئینها دارای یک منطقه ذاتا بینظم هستند که بهشکل ثابتی خم میشوند. در شرایط مناسب، انبوهی از این پروتئینها بهصورت قطرک یا میعانات جمع میشوند که یک فرآیند برگشتپذیر است. این فرایند میتواند فعالیت آنزیم را با متمرکز کردن آنزیمها همراه با سوبستراهای آنها افزایش دهد یا با جدا کردن آنزیمها از بسترهایشان، فعالیت آنها را سرکوب کند. سلولها با تغییر غلظت موضعی سوبستراها و آنزیمها در درون خود، میتوانند از میعانات برای تنظیم دقیق فعالیت پروتئین خود استفاده کنند.
اما نواحی نامنظم پروتئینها ممکن است باعث شوند که آنها بهطور دائمی بهصورت توده بههم بچسبند، سلولها را ویران و بهشدت دچار آسیب کنند. بدتر از آن، برخی از پروتئینهای معیوب نهتنها دچار کژتابی و تجمع میشوند، بلکه باعث میشوند پروتئینهای دیگر از همان نوع نیز دچار کژتابی شده و منجر به واکنش زنجیرهای تجمع شود. این موضوع از نظر مفهومی، شبیه به آن چیزی است که در بیماری جنون گاوی و نوع دیگری از سندرم کروتزفلد-جاکوب رخ میدهد که در آن پروتئینهای تاخورده که پریونها نامیده میشوند، موجی از تجمع پروتئین غیرطبیعی را در مغز تسریع میکنند.
مقاله دوم که ماه مارس منتشر شد، اطلاعات دقیقتری در این زمینه ارائه کرد. در آن مقاله تیم استنفورد پروتئینی بهنام DDX5 را که در مغز ماهیهای کیلیفیش سالخورده انباشته شده بود مورد بررسی قرار داده بودند. DDX5 که بیشترین فعالیت را در حالت میعان خود دارد، کارهای مهم مختلفی در بدن انجام میدهد که اغلب تضمین میکند پروتئینهای دیگر بهدرستی ساخته شدهاند. از روی توالی اسیدآمینه این پروتئین، محققان پیشبینی کردند که DDX5 احتمالا مانند یک پریون رفتار میکند و مطالعات بعدی آنها موضوع فوق را تایید کرد. یک پروتئین DDX5 کژتابیده باعث افزایش کژتابیها و تجمع مولکولهای دیگر DDX5 میشود.
با اینحال، این تجمع به همینجا ختم نمیشود؛ محققان استنفورد پروتئینهای متنوع دیگری را در تودههای DDX5 پیدا کردند. جان لابادیا (John Labbadia) که تیم آزمایشگاهیاش در دانشگاه کالج لندن روی کنترل کیفیت پروتئین و پیری مطالعه میکنند، توضیح داد که این تجمعها گاهیاوقات میتوانند همانند لکههای چسبنده عمل کنند که پروتئینهای دیگر را به دام میاندازند و دائم با عملکرد سلولی تداخل پیدا میکنند.
او میگوید: «این بررسی نشان میدهد که ما پروتئینهایی داریم که با افزایش سن انباشته میشوند و این امر در واقع میتواند تجمع بیشتر پروتئینها را بهشیوه پریونمانند تسریع کند، چیزی که قبلا مشاهده نشده بود».
تیم دانشگاه استنفورد با دقت مشخص کردند کدام ناحیه از پروتئین DDX5، این امکان را برای چگالش فراهم میکند تا فعالیت خود را کنترل کند و معلوم شد که این همان ناحیهای است که آن را مستعد تجمع میکند. جالب آنکه کنترل عملکرد طبیعی پروتئین و تمایل آن به تجمع بهطور گریزناپذیری به یکدیگر مرتبط هستند.
آسیبشناسی یا محافظت؟
این که دقیقا چه چیزی باعث تشکیل تودهها و تجمعها میشود و این امر چقدر میتواند برای سلولها مشکلساز باشد، همچنان یک بحث مهم و عمیق است. از یک سو، تودهها، DDX5 و سایر پروتئینها را جدا و عملا عملکردهای مهم سلولی را حذف میکنند و از سوی دیگر این تودهها ممکن است به بقای سلول کمک کنند که اثر محافظتی نام دارد.
نمونه خوبی که در خصوص اثر محافظتی میتوان به آن اشاره کرد، مطالعات صورتگرفته روی پروتئین هانتینگتین است که بیشترین فراوانی را در مغز دارد. هانتینگتین برای رشد سالم سیستم عصبی ضروری است، اما در افراد مبتلا به بیماری هانتینگتون، یک جهش باعث طولانی شدن غیرطبیعی پروتئین هانتینگتین میشود. در ادامه، پروتئین طولانی به بخشهای کوچکتر و سمی خرد میشود که به سیستم عصبی آسیب میرساند.
در سال 2004، استیو فینکبینر (Steve Finkbeiner)، محقق موسسه گلادستون و دانشگاه کالیفرنیا بههمراه گروهی از محققان، مطالعه روی تجمع پروتئین هانتینگتین در سلولهای عصبی کشتشده در آزمایشگاه را آغاز کردند. آنها نشان دادند اگرچه تمام نورونهایی که پروتئین غیرطبیعی هانتینگتین را دارند در طول زمان میمیرند، اما نورونهایی که تودههایی از هانتینگتین داشتند بیشتر از نورونهایی که این پروتئین را نداشتند زنده میمانند. فینکبینر در این ارتباط میگوید: «درک این مسئله برای انسان سخت است، زیرا بهلحاظ شهودی چیزهایی که غیرعادی بهنظر میرسند باید بد و بیماریزا باشند، اما زیستشناسی پیچیده است و پر از حلقههای بازخورد؛ بنابراین مهم است که سریع نتیجهگیری نکنیم و فریب نخوریم.»
یک چالش جهانی با راهحلهای فراوان
آن چه که در حال حاضر بهوضوح مشخص است این است که تجمع پروتئین، پدیدهای محدود به بیماریهای عصبی نیست. تجمع پروتئین بخشی از عملیات عادی هر سلول است تا به اندازه کافی عمر کند تا پیر شود. بسیاری از پروتئینهای طبیعی و مهم مانند DDX5 تمایل به تجمع دارند و مقابله با این تجمع مسئلهای است که سلولها به آن رسیدگی میکنند. از آنجایی که سلولها از دیرباز با مسئله پیشگیری از تجمع پروتئین روبهرو بودهاند، همین مسئله ممکن است نقش مهمی در تکامل توالیهای پروتئینها داشته باشد. برونت و جاروس مشاهده کردند که این پدیده در مغز ماهی کیلیفیش مشهودتر بود. از اینرو، حدس زدند که این تجمیع پروتئینها ممکن است کلید همگام شدن اندام با تغییرات زیستی باشد. اگر چنین باشد، تغییرات تکاملی در مغز که آن را به اندامی مهم در مهرهداران تبدیل کرده، ممکن است آن را در برابر بیماریهای دژنراتیو ناشی از تجمع، آسیبپذیرتر کرده باشد.
در واقع، این احتمال وجود دارد که هر بافت و اندامی باید توازن متفاوتی بین انجام کار خود و مدیریت تجمع پروتئین پیدا کند. هر بافتی الزامات و محدودیتهای عملکردی منحصربهفردی دارد. سلولهای روده دائما تغییر میکنند؛ سلولهای غدد درونریزهورمونها را میسازند و ترشح میکنند؛ سلولهای ایمنی با شناسایی مهاجمان وارد عمل میشوند؛ مغز اطلاعات را پردازش میکند. همانگونه که مشاهده میکنید، فعالیتهای مختلف به پروتئینهای متفاوتی نیاز دارند. به این معنا که استراتژیهای تکاملیافته برای مقابله با تجمع پروتئین از بافتی به بافت دیگر و از حیوانی به حیوان دیگر متفاوت است. یک فرضیه مهم که دانشمندان مطرح کردهاند این است که از آنجایی که مغز مهرهداران در گذشته نهچندان دور سریعتر از ماهیچهها تکامل پیدا کرده، سازوکار کنترل کیفیت پروتئین آن ممکن است هنوز زمان کافی برای تکامل و محافظت در برابر تجمع پروتئینهای نسبتا جدید را نداشته باشد.
همه ارگانیسمها روزانه با مشکل مهم تجمع پروتئین روبهرو هستند و این مسئله مختص زمان بیماری یا استرس شدید نیست. پروتئین DDX5 پریونمانند و پروتئینهای مشابه، میل ذاتی به تجمع دارند و ارگانیسم تلاش میکند تا از خود در برابر تجمع محافظت کند. این یک پدیده فیزیولوژیکی است که همه ما به آن روبهرو هستیم.
این واقعیت که تجمع پروتئین در سرتاسر بدن عاملی مرتبط با پیری در ارگانیسمهای زنده مثل مخمر، کرم، مگس، ماهی، موش و انسان است، نشان میدهد که ما به پژوهشهای بیشتری در این زمینه نیاز داریم.
ماهنامه شبکه را از کجا تهیه کنیم؟
ماهنامه شبکه را میتوانید از کتابخانههای عمومی سراسر کشور و نیز از دکههای روزنامهفروشی تهیه نمائید.
ثبت اشتراک نسخه کاغذی ماهنامه شبکه
ثبت اشتراک نسخه آنلاین
کتاب الکترونیک +Network راهنمای شبکهها
- برای دانلود تنها کتاب کامل ترجمه فارسی +Network اینجا کلیک کنید.
کتاب الکترونیک دوره مقدماتی آموزش پایتون
- اگر قصد یادگیری برنامهنویسی را دارید ولی هیچ پیشزمینهای ندارید اینجا کلیک کنید.





























نظر شما چیست؟